
אחד האתגרים בטיפול במחלת הסרטן הוא הצורך להבחין בין הרקמה הסרטנית לבין הרקמה הבריאה. במסגרת תחרות הביולוגיה הסינתטית iGEM, חברי הנבחרת של אוניברסיטת תל אביב [1, 2] פיתחו שיטה חדשנית לטיפול ממוקד בסרטן, המבוסס על mRNA. בנוסף, הקבוצה הציבה לעצמה מטרה – לקדם ולהנגיש את תחום הביולוגיה הסינתטית. לשם כך הם ארגנו את תחרות הישראג'ם לתלמידי תיכון, שבה השתתפו עשרות תלמידים מרחבי הארץ.
מחלת הסרטן עודנה אחד האתגרים הגדולים ביותר של האנושות. סרטן הוא שם כולל למגוון רחב של מחלות, שלכולן מאפיין בסיסי משותף – תאי הגוף יוצאים מאיזון בעקבות שינוי בחומר הגנטי, מתחלקים ללא בקרה, וכתוצאה מכך גורמים לנזק. הקושי העיקרי בטיפול נובע מחוסר היכולת להבחין בין הרקמה הסרטנית לזו הבריאה. כאמור, תאי הסרטן במקורם היו חלק מרקמה תקינה של הגוף, ולכן הם דומים מאוד לתאים בריאים. אך יש גם שוני בין תאי הסרטן לתאים הבריאים, ועל בסיס שוני זה מפותחים טיפולים רבים. לדוגמה, התרופה "Glivec" (הנמכרת על ידי Novartis) משמשת לטיפול בסוגי סרטן שונים באמצעות פגיעה בחלבון הייחודי לתאי הסרטן.
הסיבה לכך שהשינויים הגנטיים בתאי הסרטן גוררים שינוי בחלבונים וב-mRNA שהתאים מייצרים נעוצה בתפקידו החומר התורשתי בתאים שלנו, ה-DNA.
חלקים מסוימים במולקולת ה-DNA, הקרויים גנים, מכילים את ההוראות ליצירת חלבונים. ה-DNA מורכב מאבני בניין בשם נוקלאוטידים, ויש ארבעה כאלו: אדנין (A), ציטוזין (C), גואנין (G) ותימין (T). הקוד הגנטי נקבע על ידי רצף הנוקלאוטידים השונים (ה"אותיות") ב-DNA. הייחודיות של מבנה ה-DNA קשורה לאופי של הנוקלאוטידים וליכולתם להיקשר זה אל זה באופן קבוע: בתהליך שנקרא "זיווג בסיסים", A נקשר ל-T ו-C נקשר ל-G . הריבוזומים, שהם בתי החרושת לייצור החלבונים, נמצאים מחוץ לגרעין התא, ודרוש מתווך שייקח את ההוראות ה"כתובות" ב-DNA ויעביר אותן לריבוזום שירכיב את החלבון. זהו תפקידה של מולקולת ה-RNA השליח (Messenger RNA, ובקיצור mRNA): בתהליך הנקרא "תעתוק" (transcription), המידע שבגן, ה"כתוב" ברצף ה-DNA, מועבר למולקולת mRNA , יוצא מגרעין התא ומתורגם באמצעות הריבוזום לחלבון [3].
כאמור, תאי הסרטן מתחלקים ללא בקרה בעקבות שינוי בחומר הגנטי , וככל שהגידול הסרטני מתפתח, נוצרים בתאים שינויים גנטיים נוספים. שינויים ב-DNA יכולים להוביל לשינויים ברצף הגנים, שבתורם יובילו לשינוי ברצף ה-mRNA, וכתוצאה מכך גם בחלבון. המצב המתקבל הואשבתאים בריאים יש רצף mRNA תקין, ואילו בתאי הסרטן יש רצף שונה, שאינו תקין ומצוי רק בהם. בניגוד לטיפולים רבים המבוססים על שוני בין חלבון סרטני לבריא, חברי הנבחרת התמקדו בשוני אחר, שוני ב-mRNA.
כדי לנצל את השוני ברצף ה-mRNA בין תאי הסרטן לתאים בריאים לפיתוח של טיפול, יצרו הסטודנטים מולקולת mRNA סינתטית שלה מבנה ייחודי שנקרא “Toehold Switch”. מבנה זה, כפי ששמו מרמז, משמש כמתג בעל שני מצבים – סגור ופתוח. במצב הסגור, חלק מגדיל ה-mRNA המרכיב את המולקולה קשור לעצמו בזיווג בסיסים, ולמעשה יוצר מחסום פיזי לריבוזום. בשל כך, הריבוזום אינו יכול להיקשר למולקולה ולתרגם את רצף החלבון שמקודד עליה. מולקולת ה-mRNA הסינתטית מעוצבת כך שחלק מהרצף שלה יכול לבצע זיווג בסיסים עם רצף ה-mRNA הסרטני, אך לא עם הרצף הבריא. כאשר המולקולה הסינתטית נכנסת לתא סרטני ופוגשת ברצף ה-mRNA הסרטני שאיתו היא יכולה לעבור זיווג בסיסים, השניים נקשרים זה אל זה. כתוצאה מקישור זה נפרם המחסום הפיזי שמנע מהריבוזום לתרגם את החלבון המקודד, והריבוזום ניגש לבצע את עבודתו. החלבון המקודד על גבי מולקולת ה-mRNA הסינתטית הוא חלבון המוביל להרג התא הסרטני באמצעות מנגנון אשר מעכב את יכולתו לגדול. מכיוון שהרצף המצוי במולקולת ה-mRNA הסינתטית יכול לעבור זיווג בסיסים רק עם הרצף הסרטני, נפגעים רק תאי הסרטן, ללא פגיעה ברקמה הבריאה.
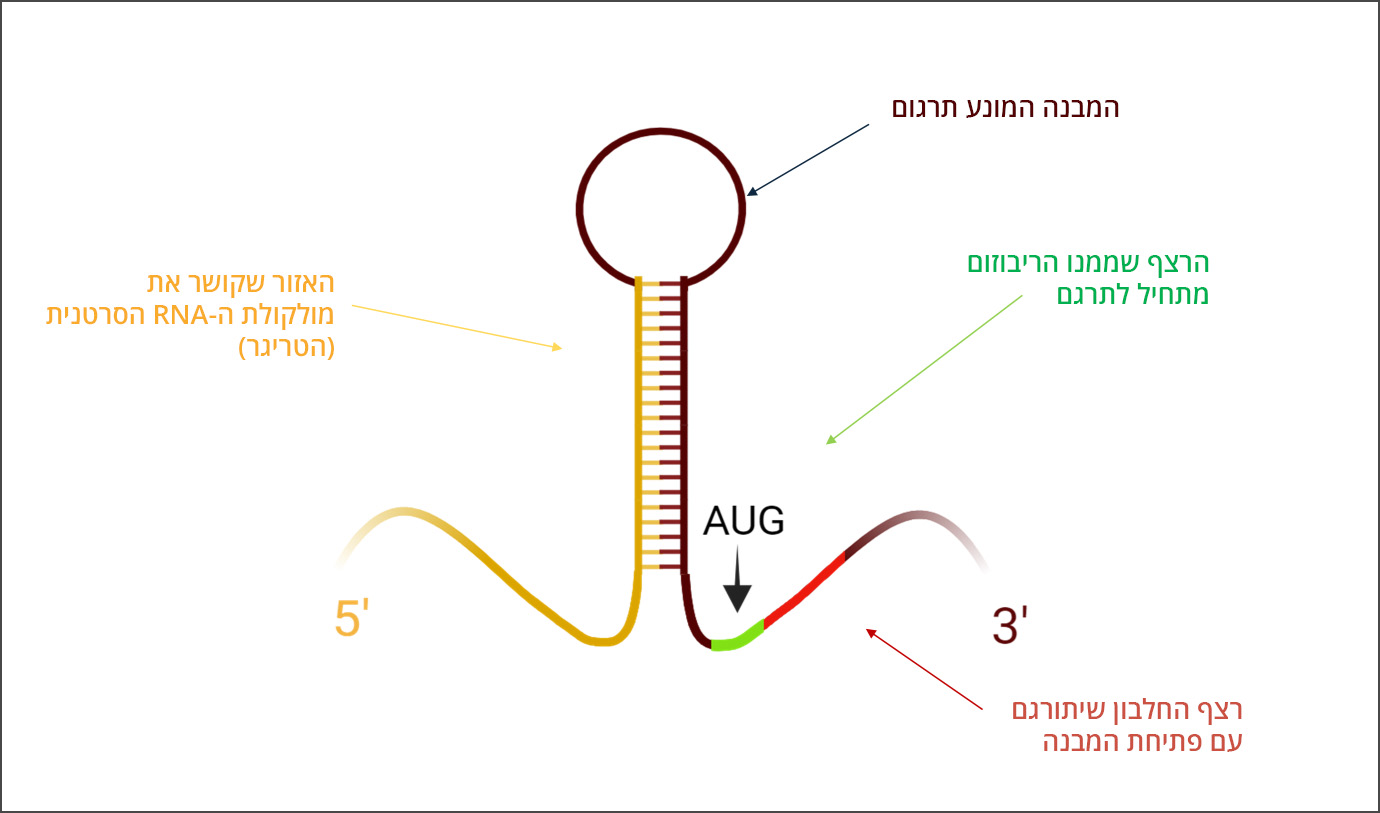
מבנה ה-Toehold Switch
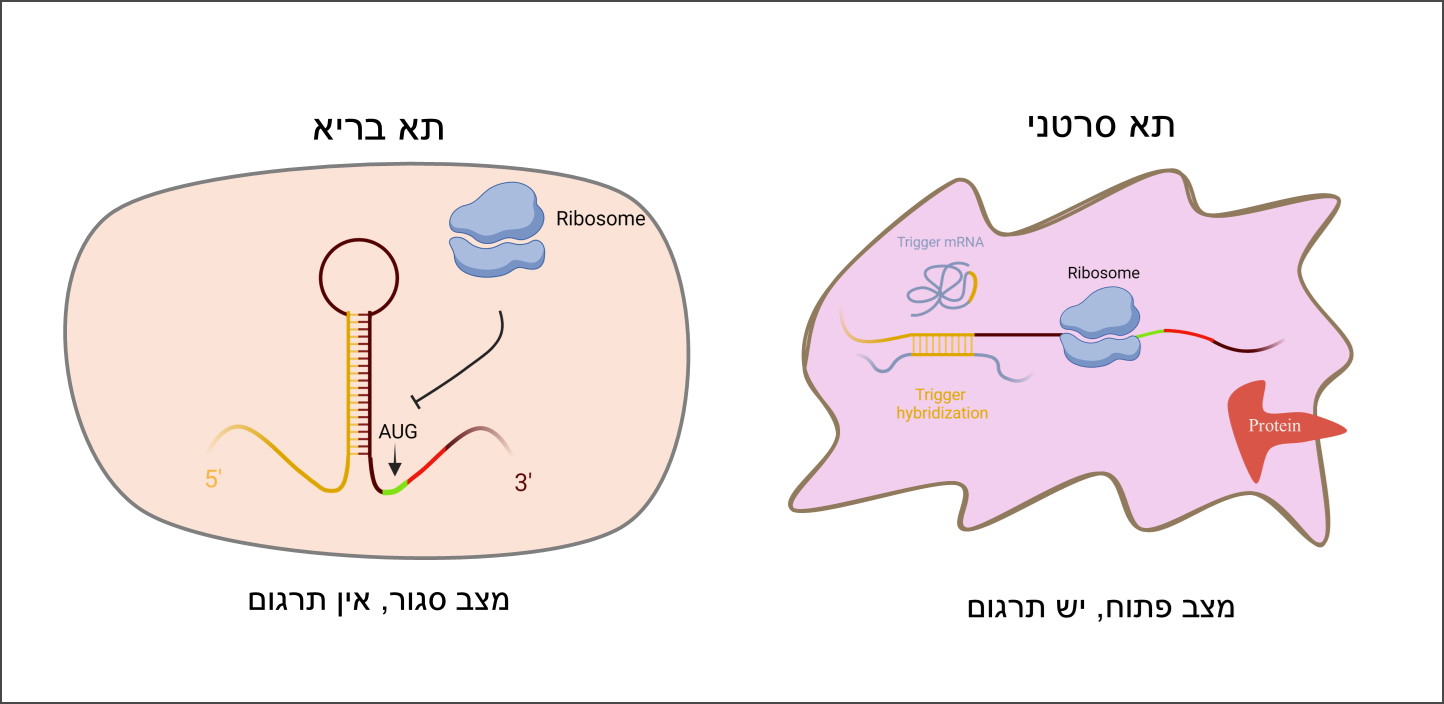
מנגנון הפעולה
כדי לפתח את הטיפול, ראשית דרוש לאתר את הטריגרים המתאימים. לשם כך ערכו הסטודנטים אנליזה של מידע על רצפי mRNA סרטניים ממאגרי מידע גדולים, ובחרו מועמדים על פי קריטריונים מסוימים (למשל – שכיחות באוכלוסיה). לאחר מכן, צריך לייצר את מולקולת ה-mRNA הסינתטית בעלת המבנה הרצוי. לשם כך השתמשו הסטודנטים בתוכנת מחשב המדמה את אופי הקישור בין הטריגר לבין המולקולת ה-mRNA הסינתטית, וניסו לחזות כיצד תתפקד המולקולה הסינתטית בעזרת מודלים המבוססים על למידת מכונה [4, 5]. לבסוף, הסטודנטים בדקו במעבדה את המועמדים שנבחרו ומדדו את כמות החלבון שהופיעה עם הטריגר ובלעדיו בתאים סרטניים ובשמרים.
חשוב לציין כי יש עוד כמה אתגרים שצריך להתגבר עליהם כדי שטיפולים מסוג זה יהיו ישימים. מולקולת mRNA נוטה להתפרק בגוף מהר יחסית, לכן צריך לפתח שיטות שישמרו על יציבותה כשהיא בדרכה אל תאי המטרה בגוף. כמו כן, לפני אישור לשימוש יש לוודא בסדרה של ניסויים קליניים שהטיפול יעיל ובטוח לשימוש. למרות האתגרים הקיימים עדיין, טיפולים כאלה מסמנים את תחילתו של עידן הרפואה המותאמת אישית: בעתיד, יוכלו רופאים לבדוק בעזרת ריצוף גנטי מהו השוני הייחודי למטופל ולהתאים עבורו מולקולת Toehold Switch ייחודית.
תכנית iGEM באוניברסיטת תל אביב:
תוכנית iGEM באוניברסיטת תל אביב משלבת מחקר ופיתוח מתקדמים בביולוגיה סינתטית עם יזמות וחברה. זו השנה השישית שאוניברסיטת תל אביב מיוצגת בתחרות ה-iGEM (International Genetically Engineered Machine) הבין-לאומית, בהנחייתו של פרופ' תמיר טולר מהפקולטה להנדסה. השנה התחרות התקיימה בפריז בסוף אוקטובר, והנבחרת זכתה במדליית זהב [6].
חינוך ויזמות בתחום הביולוגיה הסינתטית:
במהלך השנה הסטודנטים שיתפו פעולה עם כמה חברות בתחום הביוטק, היזמות והחינוך. בעזרתה של חברת ה-biofoundry אלאג'ין בדקו הסטודנטים את הקשר בין מבנה ה-mRNA הסינתטי לתפקוד הטיפולי שלו [7, 8].
החברה לתועלת הציבור Startup Nation Central (SNC) סייעה לסטודנטים בכל הקשור לעולם היזמי של הפרויקט שלהם [9]. החברה יצרה עבור סטודנטים תוכנית הכשרה, שבמהלכה הם למדו כיצד לפתח חברה מרעיון, כיצד לגייס כספים, שיטות הצגה שונות ועוד. כמו כן, SNC חיברה בין הסטודנטים לבין אנשים מובילים מתעשיית הביוטק והפארמה אשר סייעו להם בפיתוח הפרויקט.
הנבחרת שיתפה פעולה גם עם רשת בתי הספר אורט, במסגרת תחרות ה"ישראג'ם" לתלמידי תיכון [10]. זוהי תחרות שמטרתה לחשוף תלמידים לעולם הביולוגיה הסינתטית ולטפח חדשנות וחשיבה ביקורתית. לתחרות נרשמו עשרות תלמידים ממגמות ביולוגיה, ביוטכנולוגיה והנדסה ביו-רפואית מבתי ספר ברחבי הארץ. כל קבוצת תלמידים הפיקה סרטון קצר שבו תוארו הבעיה שהפרויקט שואף לפתור והפתרון המוצע. הקבוצות המובילות העפילו לשלב הגמר, שהתקיים באוניברסיטת תל אביב. ביום הגמר קיבלו התלמידים ליווי אישי מחברי הנבחרת, שיפרו את הרעיון שלהם ובנו סביבו מצגת. בסופו של היום הציגו התלמידים את הפרויקטים שלהם בפני פאנל שופטים שהורכב ממומחים מובילים מהתעשייה ומהאקדמיה: כולל פרופ' אביגדור אלדר ופרופ' איתי בנהר מהפקולטה למדעי החיים באוניברסיטת תל אביב, ד"ר אורלי סביון מחברת אלאג'ין וד"ר פרחי וקסמן ממשרד החינוך. התחרות סיפקה לתלמידים פלטפורמה לביטוי כישוריהם וחשפה אותם לתחום המרתק של הביולוגיה הסינתטית.
גל שוורץ הוא סטודנט לתואר שני במחלקה לגנטיקה מולקולרית במכון ויצמן, והיה אחד משני הקפטנים של נבחרת iGem של אוניברסיטת תל אביב לשנת 2024 במסגרת לימודי התואר הראשון בביוטכנולוגיה באוניברסיטת תל אביב.
נבחרת iGem כללה סטודנטים לתואר ראשון ולתארים מתקדמים מכמה פקולטות באוניברסיטת תל אביב.
שמות חברי הנבחרת:
שני אלימלך (הפקולטה להנדסה והפקולטה למדעי החיים), גל שוורץ (הפקולטה למדעי החיים), דניאל בן הראש (הפקולטה להנדסה), רתם גל (הפקולטה להנדסה והפקולטה למדעי החיים), אורן בן משה (הפקולטה למדעים מדויקים), נתנאל ארליך (הפקולטה למדעים מדויקים והפקולטה למדעי החיים), פלג בזק (הפקולטה להנדסה והפקולטה למדעי החיים), טל שמש (הפקולטה להנדסה והפקולטה מדעי החיים), נב צבי (הפקולטה לרפואה), יוני קליין (הפקולטה למדעי החיים), איתי פביאן (הפקולטה לרפואה) ומראנה עבוד (הפקולטה לרפואה).
עריכה: סמדר רבן
מקורות והרחבות
[3] כתבה על RNA
[4] כתבה על פרס נובל בכימיה לשנת 2024 - על שימוש בבינה מלאכותית לתכנון חלבונים
[5] כתבה על קיפול חלבונים באמצעות בינה מלאכותית
[6] כתבה על הישג הנבחרת ב-YNET
[7] האתר של Alagene
[8] כתבה של חברי נבחרת אייג'ם לשנת 2023 עם Alagene
[9] האתר של Startup Nation Central
[10] אתר תחרות הישראג'ם







