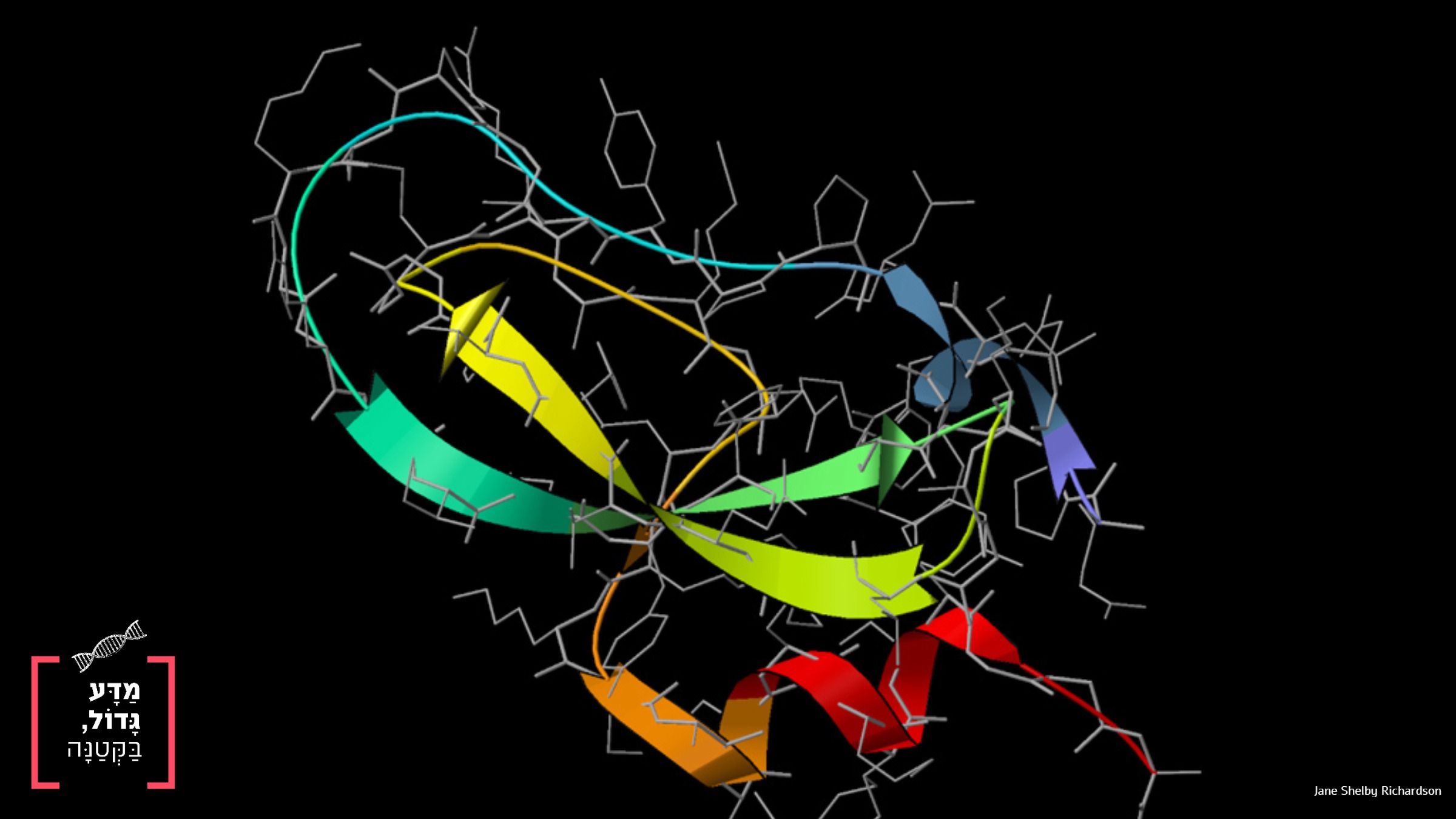
תוכנה מבית גוגל מבצעת חיזוי מדויק ביותר של קיפול חלבונים - מדויק יותר מהסימולציות הטובות ביותר כיום. מדוע קיפול חלבונים הוא נושא חשוב וכיצד חוזים את צורתם התלת-ממדית של חלבונים?
פרסומת
לחלבונים תפקיד חשוב ביותר בביולוגיה: הם מעין מכונות זעירות המבצעות תהליכים קריטיים לתפקוד התא, כגון שינוע חומרי מזון, ויסות תהליכי חילוף חומרים ובניה של שלד התא. בגוף האדם ישנם עשרות אלפי סוגים שונים של חלבונים, אשר לכל אחד מהם תפקיד ייחודי [1]. הבנה כוללת של אופן פעולת החלבונים השונים בגוף האדם עשויה לסייע במציאת הגורמים למחלות רבות ובהתוויית הדרך לריפוי מחלות אלה.
החלבונים חיוניים לתפקוד התקין של הגוף, ופעילותם תלויה במבנה המרחבי שלהם, שהוא מבנה תלת-ממדי: חלבונים הפועלים באופן שגוי עשויים לגרום נזק רציני לגוף. דוגמה ידועה היא ספגת המוח (Bovine Spongiform Encephalopathy), הידועה יותר בשם "מחלת הפרה המשוגעת". מחלה זו נגרמת כאשר חלבון מסוים במוח הפרה משנה את צורתו המרחבית באופן אשר מונע ממנו לתפקד, וגרוע מכך, גורם לחלבונים אחרים הבאים עמו במגע לשנות את צורתם המרחבית (בכך בעצם הוא "מדביק" חלבונים אחרים במצבו). חלבון "משובש" באופן זה נקרא פְּרִיוֹן (prion). פריון ששינה את הצורה המרחבית שלו עמיד בפני פירוק בתא, וכאשר מספיק פריונים משנים את צורתם הם יוצרים משקע אשר משבש את אופן פעולת התאים סביבו, ומכאן קצרה הדרך לבעיות נוירולוגיות קשות [2].
כדי להבין לעומק את אופן פעולתו של חלבון מסוים, עלינו להבין את המבנה המרחבי שלו, אשר כאמור משחק תפקיד חשוב באופן פעילותו הביוכימית. אז איך בעצם חלבונים בנויים? ברמה הבסיסית ביותר חלבונים עשויים משרשראות של אבני בניין קטנות הנקראות חומצות אמינו, הקשורות אחת לשנייה בשרשרת (הערת שוליים: ספציפית מדובר באלפא-חומצות אמינו). לכל חומצות האמינו מבנה כימי זהה, למעט חלק במולקולה הנקרא "שייר" (residue) - לכל חומצה אמינית שייר מסוג אחר. כל החלבונים בגוף האדם מורכבים מרצפים ארוכים של חומצות אמינו, מ-20 סוגים שונים. רצפים אלה נעים באורכם בין כמה מאות לכמה מאות אלפי מאבני בסיס אלה.
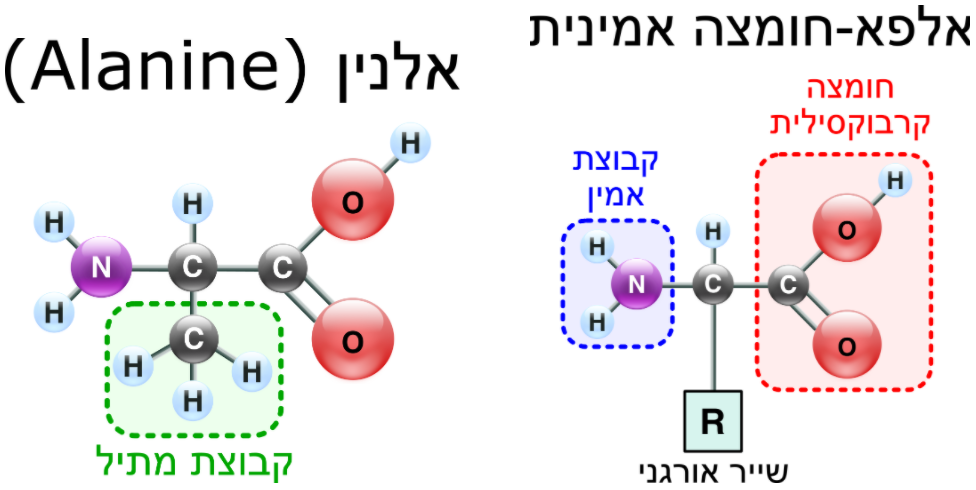
מימין, המבנה הכללי של אלפא-חומצה אמינית. משמאל, המבנה של חומצת האמינו אלנין, אחת מחומצות האמינו ההכרחיות לתפקוד תקין של גוף האדם.
בגוף האדם חלבונים מסונתזים על-ידי הריבוזום, שתפקידו הוא לחבר אלפא-חומצות אמינו זו לזו לשרשראות ארוכות. השיירים השונים בשרשרת גורמים לקיפולה במבנה תלת-ממדי ספציפי, באופן הממזער את האנרגיה של המערכת: שיירים מסיסים בשומן יטו להיות בפנים המבנה, בעוד שיירים מסיסים במים יטו להיות בחוץ המבנה, במגע עם המים בתוך התא. כמו כן, שיירים טעונים חיובית יימשכו לשיירים טעונים שלילית וידחו משיירים אחרים הטעונים חיובית, וכו'. ראוי לציין שלא כל החלבונים מתקפלים בעצמם לצורתם האופטימלית: חלקם נעזרים בחלבונים סוככים (chaperone proteins) המסייעים בתהליך הקיפול [3].
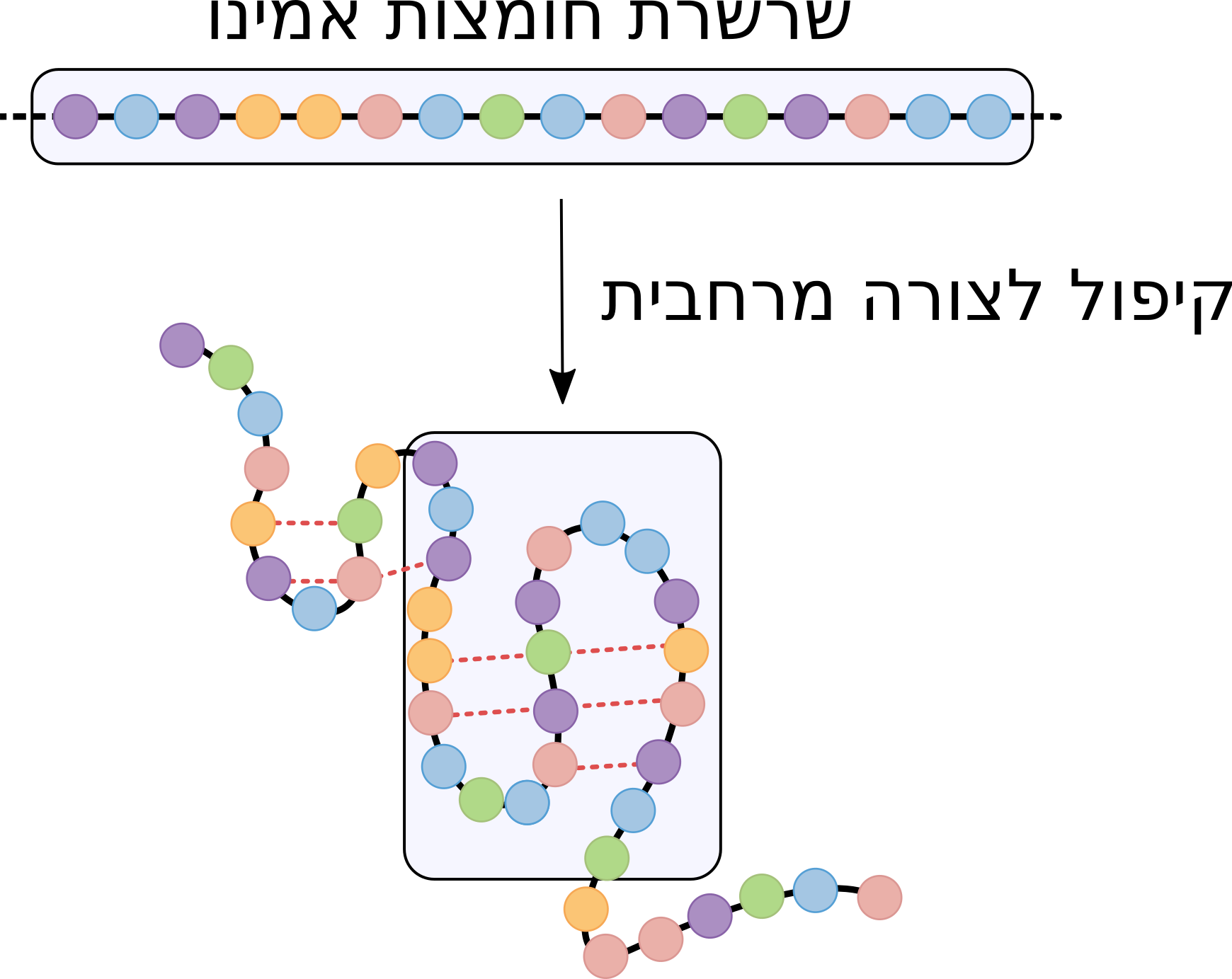
דוגמה סכמטית לקיפול של שרשרת של חומצות אמינו למבנה מרחבי. הצורה המרחבית יציבה הודות לכוחות הפועלים בין חומצות אמינו שונות (קווים אדומים מקווקוים).
ניתן לראות כי מבנה החלבון הוא מערכת פיזיקלית מסובכת מאוד, אשר מושפעת ממספר רב מאוד של משתנים. לכל חלבון ישנם מספר רב של מבנים מרחביים בעלי אנרגיה נמוכה, לעיתים אלפים ואף יותר. למדענים החוקרים את מבנה החלבון בשיטות חישוביות (כלומר, סימולציות) ישנה אם כן בעיה: איזה מבנה מרחבי (או אילו מספר מבנים בודדים) מתוך אלפי ויותר האפשרויות הוא היציב ביותר בסביבת פעילותו של החלבון? בעיה זו - חישוב נכון של קיפול החלבון בהינתן רצף חומצות האמינו ממנו הוא מורכב - היא אחת הבעיות המרכזיות בחקר חלבונים ובביולוגיה החישובית בימינו [4]. משאבים רבים מאוד מושקעים בהדמיית חלבונים שונים וקיפולם, במטרה להבין את מבנם המרחבי ובכך להעמיק את הבנתנו של אופן פעילותם.
השיטה הנפוצה ביותר לביצוע חישובים אלה נקראת דינמיקה מולקולרית (molecular dynamics): האטומים מחושבים כנקודות במרחב, ותנועתם מחושבת בעזרת פתרון משוואות התנועה של ניוטון. תנועה זו מושפעת ממאפיינים כגון המסה שלהם, הקשרים הקוולנטיים ביניהם, אופן פיזור המטען החשמלי על-פני המולקולה כולה וכו'. על מנת לשמור את החישוב מדויק ככל הניתן, הסימולציה מתקדמת בצעדי זמן זעירים, בדרך כלל בסדר גודל של פמטו-שניות (femtoseconds, fs; בכל שניה יש מיליון מיליארד - 10 ואחריו 15 אפסים - פמטו-שניות). עבור חלבונים בינוניים בסביבה פיזיולוגית (סימולציה בסדר גודל של כמה עשרות אלפי אטומים בסך הכול), אפילו בעזרת מחשבי-על ואשכולות מחשוב רבים המשתמשים במאיצים גרפיים לזרז את החישובים ניתן כיום לבצע חישוב של כמיליון צעדים במספר שעות עד ימים [5]. זה אולי נשמע כמו מספר גדול - אבל מיליון צעדים שכל אחד מהם בסדר גודל של פמטו-שניה הם בסך הכול יחד ננו-שניה (מיליארדית השניה), בעוד חלבונים מתקפלים בסדרי זמן של בין 50,000 ועד כ-1,000,000 ננו-שניות. כלומר, גם מחשבי העל החזקים ביותר נזקקים לשבועות רבים - ולעיתים אף חודשים ויותר - על-מנת לחשב קיפול של חלבון יחיד!
לאורך השנים פותחו מספר רב של שיטות המזרזות חישוב של קיפול חלבונים. אחת משיטות אלו היא ביזור החישוב על פני מספר רב של מחשבים פרטיים ומכשירים חכמים ביתיים ברחבי העולם, באופן כזה שהחישוב נעשה ברקע ובזמנים בהם המשתמשים אינם משתמשים במכשיר (למשל בלילה). פרויקט מפורסם המשתמש בשיטת חישוב זו הוא Folding @ Home ("קיפול בבית") [6].
אלגוריתמי בינה מלאכותית זוכים לפופולריות רבה יותר ויותר בשנים האחרונות. אחת משיטות החישוב הנפוצות ביותר היא רשתות נוירונים אשר יוצרות חיזוי של מערכות מורכבות על-ידי "אימון" מפרך על נתונים ומידע קיים [7]. תוכנה אחת כזו בשם Alphafold מבית היוצר של Deepmind, חברת בת של גוגל, מצליחה מזה מספר שנים לבצע את החיזוי המדויק ביותר של מבני חלבונים משרשראות חומצות האמינו שלהם. החיזוי של התוכנה הוא ברמת דיוק גבוהה מאוד - מעל למחצית מהמבנים שהיא חזתה הגיעו לדיוק של 92.4% או יותר ביחס למבנים הפיזיים של החלבונים כפי שחושבו בעזרת שיטות מדידה מוכרות (למשל קריסטלוגרפיית קרני X או תהודה מגנטית גרעינית, NMR), הרבה מעבר לשיטות חיזוי "מסורתיות" [8].
אם היכולת של Alphafold תמשיך להשתפר, היא עשויה להוות חלק חשוב בארגז הכלים הקיים לחיזוי מבני חלבונים. כל מבנה חלבון מאפשר לנו לחזות את פעילותו בגוף והשפעת גורמים שונים על התנהגותו, באופן המאפשר לנו להבין טוב יותר מנגנונים ביוכימיים בגוף - ויכולתנו להתמודד עם מחלות שונות גדלה בהתאם. דוגמה עכשווית היא חיזוי מבני של חלבוני הזיזים (spike) על-פני שטח הנגיף SARS-CoV-2 האחראי למגפת הקורונה הנוכחית [9]. הבנת מבני חלבונים אלו ואופן קשירתם לקולטנים על גבי תאי הגוף מאפשרת לנו לפתח טיפולים הממזערים קשירה זו ובכך מפחיתים את חומרת המחלה.
קישורים לקריאה נוספת:
[1] מפת חלבונים
[2] מחלות הפריונים
[3] חלבון סוכך
[4] התקדמויות ואתגרים בביולוגיה חישובית
[5] שימוש משופר במאיצים גרפיים לחישובי דינמיקה מולקולרית
[6] "קיפול בבית"
[7] רשתות נוירונים








