מערכות ביולוגיות שמשתמשות ב־RNA כדי להכווין חלבונים כך שיפעלו במיקום ספציפי, המוכרות גם כמערכות מונחות RNA, הן בעלות תפקידים רבים ואומצו במהרה על ידי חוקרים בהנדסה גנטית ככלי עבודה מרכזי, אך לא ידוע לנו כיצד הן התפתחו בטבע. במחקר שלנו, חקרנו את האבולוציה של מערכת מונחית RNA ממקור חיידקי וזיהינו את האב הקדמון שלה. למרבה ההפתעה, מצאנו כי האב הקדמון של המערכת פועל בצורה שונה – הוא אינו מונחה על ידי ה־RNA כדי לבצע פעילות, אלא דווקא מעוכב על ידו. אנו משערים שקיים מסלול אבולוציוני שבו RNA עבר מתפקיד המעכב של פעילות החלבון לתפקיד המנחה של פעילות החלבון. ממצאים אלו מספקים תובנות חדשות על התפתחות מנגנוני הגנה בחיידקים ופותחים אפשרויות לשיפור מערכות קיימות בהנדסה גנטית
פוסט אורח מאת שי זילברצוויג־טל, פוסט־דוקטורנטית ממכון ברוד ו־MIT, ממובילות המחקר
לפני מספר חודשים אושר הטיפול הראשון לעריכה גנטית באנמיה חרמשית – צעד פורץ דרך ברפואה הגנטית [1]. בגוף האדם יש כ-20,000 גנים, ומטיפולים מבוססי עריכה גנטית נדרשת יכולת לפגוע בדיוק מרבי בגן ספציפי אחד. זהו אתגר משמעותי, שכן מידת הדיוק הנחוצה משולה למציאת מחט בערמת שחת – זיהוי גן יחיד מתוך עשרות אלפים. ההתקדמות המרשימה בתחום התאפשרה בזכות מערכת ביולוגית יוצאת דופן שמקורה בחיידקים, שהתפתחה כהגנה טבעית מפני נגיפים שתוקפים אותם.
מערכת CRISPR-Cas13 בחיידק | מקור: Domdomegg, Wikipedia
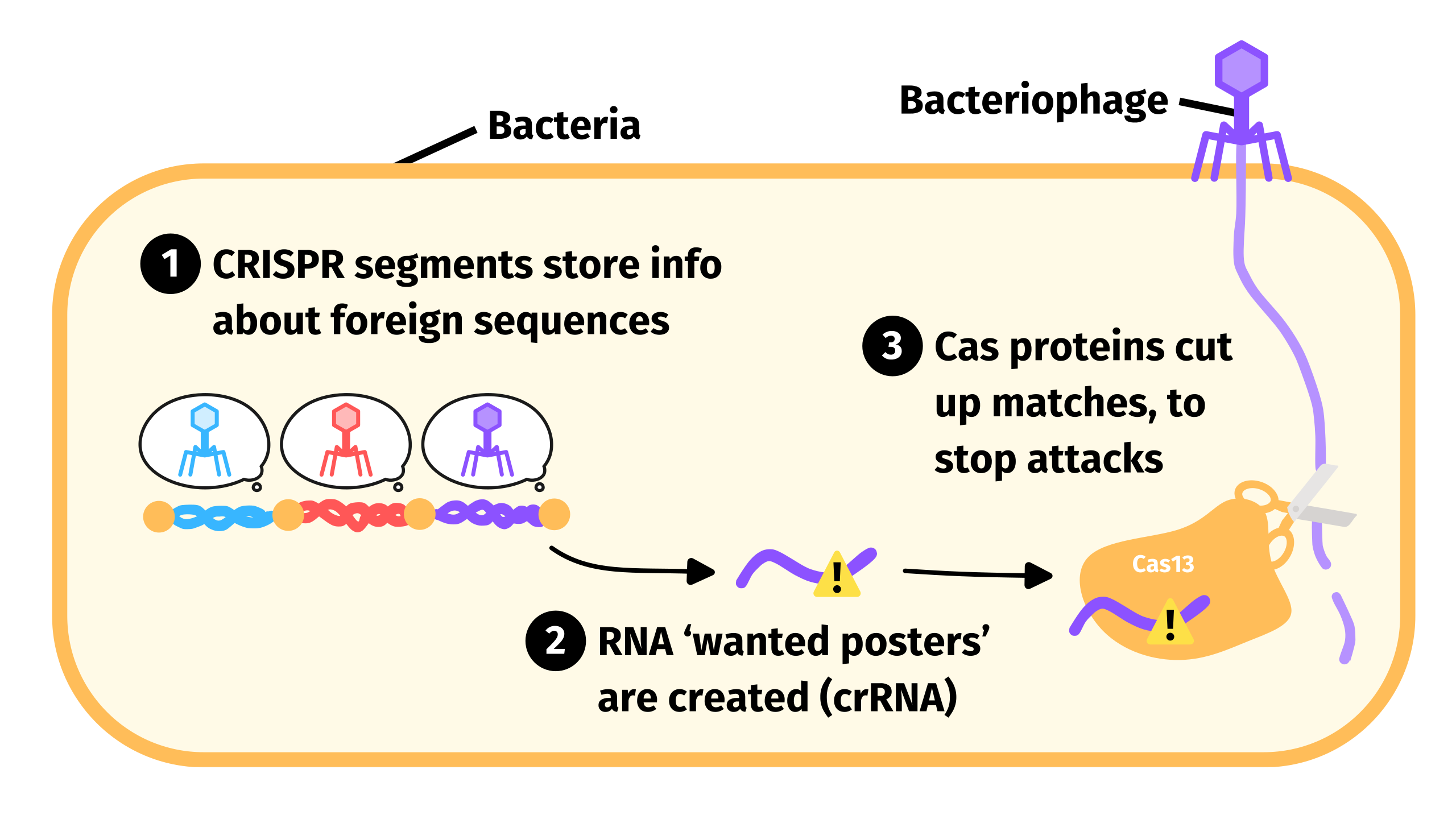
חיידקים ובקטריופאג'ים, או בקיצור פאג'ים, נגיפים תוקפי חיידקים, נמצאים במאבק מתמיד: החיידקים מפתחים מנגנוני הגנה, ואילו הפאג'ים מנסים לעקוף אותם. אחד ממנגנוני ההגנה היעילים ביותר שהתפתחו בחיידקים הוא מערכת CRISPR, המורכבת ממולקולת RNA ומאנזים שמסוגל לחתוך DNA או RNA. יחד, הם יוצרים מערכת המזהה את החומר התורשתי של הנגיף וחותכת אותו, ובכך מונעת ממנו להתפשט ולהדביק תאים נוספים [2]. מרכיב ה־RNA במערכת הוא שמעניק לה את יכולת הזיהוי: הוא מזהה במדויק את ה־DNA או ה־RNA של הפאג' ומנחה את האנזים לחתוך רק אותו, תוך שמירה על החומר התורשתי של החיידק עצמו מכל פגע. ללא הספציפיות הזו, המערכת עלולה לפגוע גם בחיידק בנוסף לפגיעתה בנגיף.
מערכות כאלה נקראות מערכות מונחות RNA (באנגלית RNA-guided systems), והן אומצו במהירות ליישומים ביוטכנולוגיים שונים. לדוגמה, הנדסה גנטית – באמצעות שינוי רצף חומצות הגרעין של מולקולת ה־RNA ניתן לכוון את המערכות האלו לגנים ספציפיים, למשל לכוון אותן להכיר גן שמכיל מוטציה. באמצעות הנדסת החלק החלבוני של המערכת ניתן גם להוסיף פעילויות נוספות, כמו הוספה של גן תקין. למעשה, בטבע קיימות מערכות נוספות המבוססות על הנחיית RNA, שיש להן תפקידים מגוונים – ואפילו בתאי אדם! דוגמאות לכך הן המיקרו־RNA, מולקולות קטנות המבקרות ביטוי גנים [3,4].
השאלות כיצד התפתחו מערכות מונחות RNA ומה היו הגרסאות הקדומות שלהן מסקרנות במיוחד, גם מבחינה אבולוציונית וגם מבחינה הנדסית. האם מנגנונים קדומים שהתבססו על חלבונים או RNA בלתי־מונחה היוו את הבסיס להופעת מערכות אלו? יתרה מזאת, אם נדע כיצד המערכות האלו התפתחו נוכל להנדס ולשפר מערכות קיימות, כמו אלו שמשתמשים בהן להנדסה גנטית, ואולי אף לפתח מערכות חדשות עם פעילות שונה.
במחקר שלנו התמקדנו במערכת CRISPR-Cas13, מערכת שבה האנזים Cas13 חותך RNA ולא DNA. מטרתנו הייתה לזהות את האב הקדמון של Cas13 ולחקור כיצד המערכת הזו התפתחה [5]. כדי לעשות זאת, התמקדנו באזורי החלבון השמורים, כלומר אזורים שהרצף שלהם נשמר לאורך האבולוציה, שהם חיוניים לחיתוך ה־RNA. האנזים Cas13 מתאפיין בכך שהוא מכיל שני אתרים נפרדים (דומיינים) חותכים ודומים, ולכן חיפשנו חלבונים המכילים דומיין אחד כזה לפחות.
באמצעות השוואת המבנה ורצף חומצות האמינו של Cas13 לכל החלבונים החיידקיים הידועים במסדי הנתונים, בנינו אילן יוחסין המתאר את הקשרים האבולוציוניים בין כלל החלבונים החיידקיים שמכילים לפחות דומיין חיתוך אחד. באילן היוחסין הזה, קבוצת החלבונים הנקראת AbiF, המכילה רק דומיין חיתוך אחד, הייתה הדומה ביותר ל־Cas13 שמכיל שניים. ממצא זה רמז שייתכן ש־AbiF הוא האב הקדמון של Cas13. כדי לבסס את הרעיון בחנו את הרצפים ב־DNA החיידקי אשר מכילים את ההוראות לייצור החלבון AbiF ומצאנו כי ברוב המקרים, נוסף על הרצף שמורה לייצר חלבון נמצא גם רצף שמכיל הוראות לייצור RNA.
אולם, לא היה ברור אם AbiF גם הוא מערכת מונחית RNA בדומה ל־Cas13, או שמא יש לו תפקיד ביולוגי אחר. להפתעתנו, מצאנו כי AbiF אינו מערכת מונחית RNA כלל! במקום זאת, גילינו שהוא מקיים מערכת הגנה אחרת של רעלן ואנטי־רעלן. במערכות מסוג זה, הרעלן הוא החלבון שיכול לחתוך RNA בסביבתו ללא אבחנה – במקרה הזה AbiF – והאנטי־רעלן מעכב את הפעילות שלו – במקרה שלנו מדובר באותו RNA שמקורו בהוראות הייצור ברצף הסמוך לרצף שמוביל לייצור החלבון AbiF.
מערכות אלו קשורות למערכת החיסון של החיידקים. הן משמשות כמנגנון לשימור אוכלוסיית החיידקים ומאפשרות להם להתמודד עם הדבקה בנגיפים. כאשר פאג' חודר לתא החיידק, מערכת הרעלן/ אנטי־רעלן מופעלת, בדרך כלל על ידי כך שהאנטי־רעלן מפסיק לעכב את הרעלן. התוצאה היא מוות מהיר של תא החיידק, מה שמונע מהפאג' להתרבות ולהתפשט לחיידקים נוספים. זהו מהלך זולתני (אלטרואיסטי), המוכר גם בשם הדבקה הַפְסָקָנית (abortive infection), שמטרתו להגן על אוכלוסיית החיידקים מפני הדבקה נרחבת. למעשה גם המערכת ש־Cas13 התפתח ממנה קשורה להגנה מפני פאג׳ים.
חיידקים מותקפים על ידי פאג'ים | Milka Leppanen, Wikipedia
כדי להבין את התהליכים שאפשרו למערכת שמעוכבת על ידי RNA להיות מונחית על ידי RNA, פענחנו את המבנה התלת־ממדי של AbiF, כלומר קבענו מה צורתו במרחב, וגילינו כי החלבון מתפקד כהומודימר, כלומר, שתי יחידות זהות של החלבון מתחברות ופועלות ביחד. נזכיר ש־Cas13 מכיל שני דומיינים חותכים, בעוד ש־AbiF מכיל רק דומיין חיתוך אחד. מצאנו שהחיבור של שתי היחידות של AbiF הוא המפתח ליכולתו לבצע חיתוך של RNA, מה שמרמז כי זהו מנגנון ביניים בין AbiF הקדום למערכת מונחית RNA מודרנית כמו Cas13. בנוסף, באמצעות פענוח המבנה של AbiF, מצאנו שה־RNA האנטי־רעלן נקשר לחלבון AbiF באזורי דומיין החיתוך, מה שמונע ממנו לעבוד, ואילו ה־RNA של Cas13 נקשר לחלבון עם מולקולת ה־RNA המנחה שלו באזורי חלבון אחרים, וכך הופך למנחה.
אז מה השגנו במחקר ומה הצלחנו להראות? למעשה אנו מציגים מסלול אבולוציוני אפשרי שהוביל להתפתחות מערכת מונחית RNA כגון Cas13 ממערכת מבוקרת כגון AbiF. מסלול זה כולל הכפלת גנים – היווצרות עותק נוסף של הגן האחראי לייצור החלבון, שלאחריה התחברו שני העותקים לגן אחד, מה שאיפשר יצירה של שני דומיינים חותכים בתוך אותו חלבון.
התגלית שלנו לא רק עונה על שאלות מדעיות חשובות בנוגע להתפתחות מנגנוני הגנה בחיידקים, אלא גם מספקת בסיס להנדסה עתידית של מערכות חדשות ומשופרות. הבנת הדרך שבה מערכות מונחות RNA התפתחו בטבע עשויה לעזור לנו לתכנן ולשפר כלים ביוטכנולוגיים עם מגוון יישומים – מהנדסה גנטית ועד לריפוי גנטי ממוקד.
מקורות
- כתבה על טיפול מבוסס CRISPR שאושר לשימוש לחולים באנמיה חרמשית
- כתבה על פרס נובל לכימיה לשנת 2020 שהוענק על גילוי מערכת CRISPR
- כתבה לכבוד יום ה־RNA
- כתבה על פרסי נובל לשנת 2024 כאשר הפרס לרפואה הוענק על גילוי microRNA
- המאמר המקורי שפורסם ב־Cell








