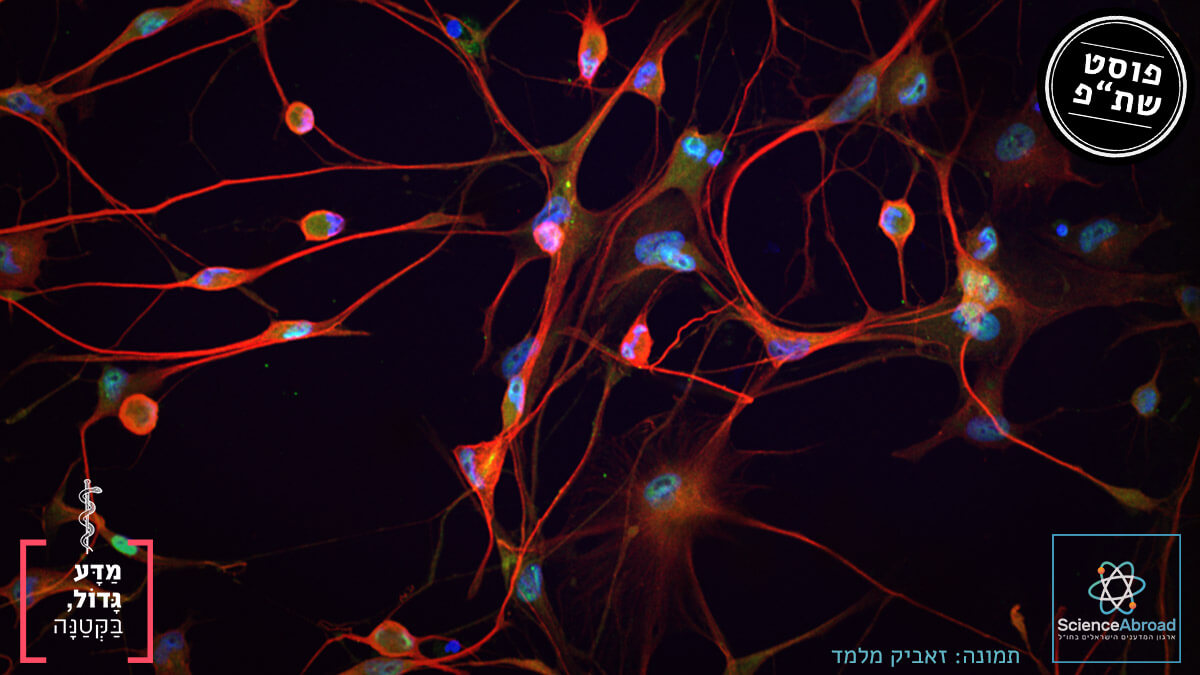
ALS היא מחלה ניוונית המאופיינת בפגיעה בתאי מערכת העצבים הקשורים לתנועה. מחקר בהובלת ד"ר זאביק מלמד באוניברסיטת קליפורניה בסן דייגו, גילה שבתאי העצב הפגועים יש מחסור בחלבון בשם סטאטמין-2. חלבון זה אחראי על תפקוד תקין של תאי העצב ועל השתקמותם לאחר פגיעה. החוקרים העלו את רמות החלבון בתאי עצב פגועים בתרבית והצליחו לשקמם.
בשנת 2014 ג'סטין ביבר, טיילור סוויפט, כריס פראט וידוענים נוספים שפכו על עצמם דלי מלא במי קרח. הסיבה שהם עשו את הדבר המשוגע הזה היא על מנת לגייס כסף למחקר של מחלת ה-Amyotrophic Lateral Sclerosis (ALS) הידועה גם בכינוי מחלת לו גריג [1]. ALS היא מחלה ניוונית המחמירה במהירות לכדי שיתוק, המאופיינת בפגיעה בתאי עצב הקשורים לתנועה. התסמינים מתחילים מחולשה בשרירים, קושי בבליעה ובדיבור, ובשלבים המאוחרים של המחלה החולים מאבדים שליטה בשרירים, כך שיכולות הדיבור, הבליעה והנשימה נפגעות כמעט לחלוטין. חולה ידוע ב-ALS הוא הפיזיקאי סטיבן הוקינג, אשר חי כ-40 שנה לאחר שאובחן כחולה, ונזקק לסיוע של כיסא גלגלים והנשמה. הוקינג אמנם המשיך לעבוד כפיזיקאי ולהרצות ברחבי העולם במשך שנים רבות, אולם עבור מרבית החולים המצב שונה. תוחלת החיים הממוצעת מזמן האבחון היא 3-5 שנים, ולכן חוקרים רבים מנסים להבין את המנגנונים המובילים למחלה, ומשקיעים מאמצים בפיתוח טיפולים חדשים. למרות המאמצים הרבים, כיום אין עדיין תרופה למחלה.
במחלה, הפורצת בדרך-כלל בין הגילאים 55 ל-75, תאי העצב המפעילים את השרירים מתנוונים, ועל כן השרירים נחלשים ובסופו של דבר מאבדים תפקוד ומתים. אחד מהמאפיינים הביולוגיים של ALS הוא שברבים מהחולים ישנה פגיעה בתפקוד התקין של חלבון בשם TDP-43. תפקידו של החלבון TDP-43 הוא לבקר ביטוי גנים רבים, חלקם נמצאו כקשורים ל-ALS. למרות ההבנה הבסיסית של תפקיד החלבון, הידע בנוגע לפעילותו התקינה ופעילותו במחלה מוגבל, וחוקרים רבים עדין מנסים לפענח את המנגנונים, על מנת לפתח טיפולים עתידיים.
ד"ר זאביק מלמד חוקר כיצד החלבון TDP-43 מתפקד בתאי העצב הקשורים לשריר (תאי העצב המוטוריים), מכיוון שאלו התאים אשר נפגעים ב-ALS. בעוד שמרבית המחקר ב-ALS מתבצע בחיות מודל, ד"ר מלמד ביצע את המחקר תוך שימוש בתאים מבני אדם, על ידי שימוש בטכנולוגיה חדשה אשר פותחה בעשור האחרון. בטכנולוגיה זו, ניתן להפוך תאים שנלקחו מעור של אדם בריא או חולה לתאים של איבר אחר, במקרה הזה, תאי העצב המוטוריים. פיתוח השיטה הזו, מאפשר לחקור מחלות רבות, ולחוקר שגילה אותה, שינייה יאמאנקה (Shinya Yamanaka), הוענק פרס נובל [2,3] בשנת 2012. השיטה הזו קידמה את המחקר של מחלות אשר קשה לבודד בהן את התאים החולים, כמו מחלות נוירולוגיות. כיום, קבוצות מחקר רבות משתמשות בשיטה הזו על מנת לפענח מנגנוני מחלה ולפתח טיפולים תרופתיים.
במחקר נעשה שימוש בתאי עור, אשר בשימוש בטכנולוגיה לעיל הפכו לתאי עצב מוטוריים שנפגעים במחלת ה-ALS. בתחילה, הקבוצה השתמשה בתאים מתורם בריא, על מנת לחקור את המנגנון התקין של TDP-43. הם מצאו שהפגיעה בתפקוד החלבון TDP-43, אשר פוגמת בהובלה שלו אל גרעין התא, מונעת ייצור של חלבון אחר בשם סטאטמין-2 (Stathmin-2). סטאטמין-2 הוא חלבון חשוב אשר עוזר לייצב את המבנה הייחודי של תאי עצב שכולל שלוחות ארוכות שיוצאות מתא העצב ומגיעות אל השריר. במחקר התגלה כי סטאטמין-2 חשוב לבנייה מחדש של תאי העצב לאחר פגיעה, ופגיעה בייצור שלו גורמת לנזק בתאי העצב. העובדה כי לסטאטמין-2 יש תפקיד בשלוחות של תאי עצב תקינים הייתה ידועה קודם לכן, אולם חשיבותו בשיקום לאחר נזק, במיוחד עקב פגיעה ב-TDP-43, לא היתה ידועה. עובדה זו יכולה להסביר את הנזק שמתרחש במחלת ה-ALS.
בהמשך, על מנת לוודא שהממצא מתרחש בחולים, הקבוצה בדקה את תאי העצב המוטורי של חולי ALS, שהם בודדו מרקמת חוט השדרה של חולים ב-ALS לאחר המוות. הם מצאו שאכן רמות סטאטמין-2 נמוכות בתאי העצב המוטורי שהופקו מחולי ALS. בעקבות ממצאים אלה, מציעה קבוצת המחקר להתמקד בהעלאת רמות סטאטמין-2 כטיפול חדשני במחלה. כאשר ד"ר מלמד וחברי קבוצת המחקר העלו את הרמות של סטאטמין-2 בתאים, הם הצליחו להפחית את הפגיעה בתאים ולגרום לבנייה מחדש של תא העצב. כתוצאה מכך, התפקוד של תאי העצב השתפר ונראה שזהו כיוון מבטיח בשיקום יכולתם לבצע את הובלת המידע אל השריר.
החוקרים מצאו שהטיפול שיפר את תפקוד התאים בתרבית, אולם יש עדיין לבצע ניסויים במודלים נוספים (למשל בחיות) ובבני אדם, על מנת להעריך האם הטיפול אכן ישפר את התסמינים ויאריך חיים. TDP-43 מעורב במחלות ניווניות חמורות נוספות, ולכן הבנת מנגנון פעילותו יכול לסייע במציאת טיפולים במחלות האלו. בנוסף, למרות שהמנגנונים בבסיס ALS שונים ממחלות נוירולוגיות ניווניות אחרות, וקיימים מנגנונים נוספים בבסיס המחלה שאינם תלויי TDP-43, האסטרטגיה ששימשה את החוקרים יכולה לשמש גם חוקרים של מחלות אחרות בבואם לפתח טיפולים תרופתיים חדשניים. המאמר המתאר את תוצאות המחקר פורסם בעיתון Nature Neuroscience בתחילת 2019 [4], ובנוסף הקבוצה ממשיכה בפיתוח אסטרטגיות טיפוליות, בשיתוף פעולה עם חברת הביוטק המקומית Ionis Pharmaceuticals.
שיטות מחקר חדשניות מאפשרות לחקור את מחלת ה-ALS ומחלות נוירולוגיות אחרות, בצורה שלא היתה אפשרית בעבר. המחקר בתאים מבני-אדם, ולא חיות מודל, ובתאים המדוייקים שנפגעים במחלה, מאפשר לגלות מנגנונים חדשים שאי אפשר היה לגלות בעבר. בזכות המחקר פורץ הדרך של ד"ר מלמד וקבוצתו אנחנו מבינים טוב יותר את המחלה, והתגלית יכולה להוביל לפיתוח של תרופה למחלה שכיום נחשבת לחשוכת מרפא.
הטקסט נכתב על ידי ד"ר דורית טרודלר מעמותת סיינס אברוד בשיתוף עמותת מדע גדול, בקטנה.
ד"ר טרודלר חוקרת את תפקיד מערכת החיסון במחלות נוירולוגיות במעבדתו של פרופ' סטוארט ליפטון במכון סקריפס שבסן דייגו, קליפורניה.
ד"ר זאביק מלמד סיים את לימודי הדוקטורט בפקולטה לרפואה באוניברסיטת תל אביב בהנחייתו של פרופ' גיל אסט. במהלך הדוקטורט הוא חקר מנגנוני בקרה ועיבוד של חומצות גרעין מסוג RNA. הוא התחיל השתלמות פוסט דוקטורט בשנת 2014 באוניברסיטת קליפורניה בסן דייגו, והוא ממשיך במחקר להבנת התהליכים שמובילים לפגיעה ב-ALS ובפיתוח של טיפול עתידי. ד"ר מלמד הוא חבר פעיל בארגון ScinceAbroad ומשמש כרכז הארגון בסן דייגו. במסגרת התנדבותו הוא מארגן אירועים (מדעיים ולא מדעיים) לחברי הקהילה המדעית הישראלית המקומית וכן מתאם אירוח של מדענים ישראליים אשר מבקרים בסן דייגו.
עמותת סיינסאברוד (ScienceAbroad) היא ארגון ללא כוונת רווח הפועל משנת 2006 לאיגוד מדעניות ומדענים ישראלים בחו"ל. מטרתה לחזק את הקשרים עם חוקרות וחוקרים ישראלים בעולם והשבת מוחות לישראל. קהילת המדעניות והמדענים של סיינסאברוד מונה יותר מ-3000 אנשי מחקר מהאוניברסיטאות הטובות בעולם. ארגון סיינסאברוד מעניק כלים, מפתח קשרים ופותח דלתות למדעניות ומדענים ישראלים המבקשים לשוב לישראל, על מנת שיביאו עימם את הידע, הניסיון והקשרים שצברו בחו"ל אל האקדמיה והתעשייה הישראלית, כמנוע צמיחה . בנוסף, חברי הארגון מעורבים בפרויקטים לשיפור תדמיתה של ישראל ומיתוגה של ישראל כמרכז מחקר ופיתוח, וכן להנגשת המדע לקהל הרחב בישראל ובעולם.
בתמונה: תרביות תאי עצב מוטוריים שיוצרו במקור מתאי עור של חולים. באדום - תאי עצב; בירוק - TDP-43; בכחול - גרעין התא. קרדיט: זאביק מלמד
מקורות וקישורים לקריאה נוספת:
[1] על לו גריג בוויקיפדיה העברית
[2] על שינייה יאמאנקה באתר פרס נובל
[3] על פרס הנובל שהוענק לשינייה יאמאנקה באתר פרס נובל
[4] קישור למאמר המדעי
Melamed et al. - Premature polyadenylation-mediated loss of stathmin-2 is a hallmark of TDP-43-dependent neurodegeneration








