צוות מדענים ממכון גלדסטון שבאוניברסיטת קליפורניה בסן פרנסיסקו, בשיתוף פעולה עם חברת ביוטק מעמק הסיליקון פיתחו טיפול שמבוסס על הנדסה גנטית של תאי מערכת החיסון, המאפשר להרוג באופן סלקטיבי תאים שנדבקו בנגיף ה HIV. העבודה פורסמה בכתב העת היוקרתי Cell.
פרסומת
הטיפול בנגיף ה-HIV ובמגפת ה-AIDS הם הצלחה גדולה בעולם המדע ב-30 השנים האחרונות. כיום, נשאים רבים של הנגיף מטופלים בכדור אחד ליום ואינם מדבקים [1]. אולם, נגיף ה-HIV, בשונה מנגיפים רבים, אינו מפונה מגוף החולה לאחר הטיפול. הנגיף מחדיר את עצמו לתוך ה-DNA, כך שהוא נמצא בתאי החולה לאורך כל חייו, והוא יתפרץ כשהתרופות לא יהיו בסביבה לעצור אותו. מאגר התאים שנדבקו בנגיף ולא מפונים לעולם נקרא המאגר הרדום (Latent reservoir), והוא המכשול לריפוי המוחלט של החולים.
במהלך העשורים האחרונים, נמצאו ברחבי העולם נשאים של הנגיף, שהפסיקו את הטיפול לאחר שנים, ולמרות זאת מערכת החיסון שלהם הצליחה לשמור את הנגיף תחת בקרה. אחת הסיבות לכך היא שהמאגר הרדום היה קטן במידה כזו שמערכת החיסון יכלה להתמודד איתו.
כיום, ישנן מספר גישות להתמודדות עם המאגר הרדום. במעבדה של פרופ' וורנר גרין, חוקר HIV במכון גלדסטון שבאוניברסיטת קליפורניה בסן פרנסיסקו, פועלים לפתח שיטות להוצאת המאגר מהתרדמת שלו, כך שיחזור לפעילות, ובתוך כך יחזור להיות נגיש לחיסול על ידי מערכת החיסון. שיטות להקטנת המאגר כוללות שימוש בנוגדנים מנטרלים או שימוש בתאים הורגים לחיסול התאים המודבקים.
תאי CAR-T הינם תאים שנלקחים ממערכת החיסון של חולה ומהונדסים גנטית במעבדה כדי לבטא חלבון מסוים על גבי מעטפת התא שלהם, למשל חלק מנוגדן. כאשר התאים האלו מוחזרים לגוף החולה הם תוקפים באופן ממוקד תאים אחרים המבטאים את חלבון המטרה שהונדסו כנגדו. כיום, תאי ה CAR-T יכולים להרוג תאים סרטניים והם כבר משמשים כטיפול כנגד סוגים מסוימים של סרטן [2]. הם אמנם מצליחים להרוג ביעילות גם תאים שהודבקו בנגיף ה-HIV, אך ההגנה היא לתקופה מוגבלת. קושי נוסף של השיטה הוא שהן תאים סרטניים והן תאים שמודבקים ב-HIV מנסים לחמוק ממערכת החיסון. לשם כך הם משנים באופן תדיר את החלבונים שמשמשים ״תעודת זהות״ לתא, כלומר, החלבונים שמערכת החיסון מזהה. על מנת להתגבר על השינויים האלה, אנו זקוקים למערכת שתוכל להתאים את עצמה למופעים שונים של התאים שאנו מעוניינים לחסל, וזאת בצורה קלה ובטוחה.
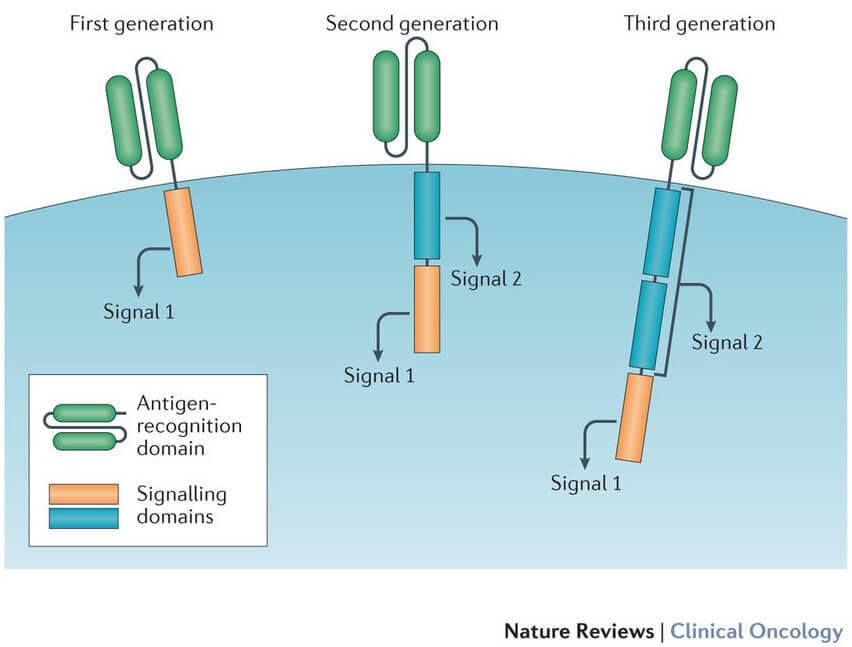
החוקרים במעבדה, בשיתוף עם חברת ביוטק מעמק הסיליקון, פיתחו מערכת המשלבת שני גורמים שונים במערכת החיסון, אשר יפעלו רק כאשר שניהם נמצאים ביחד. הגורם הראשון הוא נוגדנים אשר יודעים לזהות באופן מדויק תאים שהודבקו בנגיף ה-HIV. הגורם השני הוא תאי CAR-T אשר מזהים רק את הנוגדנים כנגד הנגיפים ולא מזהים שום מטרה אחרת בתאי החולה. כאשר נותנים לחולה את שני החלקים, הנוגדנים יזהו את התאים שמודבקים בנגיף ויצמדו אליהם, ואילו תאי CAR-T יזהו את הנוגדנים. באופן הזה הם יגיעו ישירות אל התא המודבק בנגיף ה-HIV ויהרגו אותו על מנת שהנגיף לא יוכל להמשיך להדביק תאים נוספים. באופן הזה משיגים שני יתרונות מרכזיים: הראשון, המערכת מדויקת להפליא, שכן תאי CAR-T, תאי ההרג, מגיעים ישירות אל התאים המודבקים והורגים רק אותם. השני, ניתן להשתמש באותו תא הרג בצירוף נוגדנים שונים אשר מתאימים לזנים שונים של הנגיף. החוקרים בחרו לקרוא לה convertibleCAR-T, כי היא מודולרית כמו מכונית עם גג נפתח, שניתן לפתוח ולסגור, בדומה לאופן שבו ניתן להוסיף נוגדנים שונים על מנת להפעיל את המערכת.
נגיף ה-HIV מתחבא בעיקר ברקמות של מערכת החיסון כמו השקדים והטחול. החוקרים בדקו האם המערכת מצליחה להוריד את מספר התאים המודבקים בזנים שונים של הנגיף בתאים אנושיים שמקורם בשקדים ובטחול, כמדד ליכולתה לחסל את הנגיף ״בסביבתו הטבעית״. בניסויים רבים שנערכו בתאים אלו הצליחו החוקרים להוכיח שהמערכת אכן הורגת באופן ספציפי את התאים המודבקים, והיא אינה הורגת תאים שלא מודבקים בנגיף. כמו כן, כפי שחזו, היא פעילה רק כאשר שני החלקים נמצאים. בנוסף, כאשר החוקרים בדקו את המערכת על דם שנלקח מנשאי HIV הם הצליחו להוריד את מאגר התאים המודבקים ב-50% בטיפול קצר של יומיים בלבד.
ממצא מבטיח נוסף הוא היכולת של המערכת לפעול באותו זמן להרג הן של תאים מודבקים בנגיף ה-HIV והן נגד תאים סרטניים. בעתיד ניתן יהיה לטפל בעזרת התאים האלו בשתי מחלות באותו חולה על ידי הזרקה של קוקטיל הנוגדנים הספציפי נגד שתי המחלות. [3]
כעת נערכים ניסויים נוספים בבעלי-חיים, על מנת להביא את המערכת לשימוש בבני אדם לטיפול בחולי סרטן ובנשאי HIV. בעתיד, החוקרים מקווים שטיפול בחולים אלו יהיה מורכב מטיפול חד פעמי משולב של תאי ה- CAR-T ושל נוגדנים המתאימים לסוג הסרטן או הנגיף. למרות התוצאות המבטיחות, המראות שיפור לעומת השיטות הקיימות כיום, ידרשו עוד שנים ארוכות עד שטיפול זה יאושר כטיפול בחולים.
מאת ידיד עמותת מדע גדול, בקטנה וממחברי המאמר איתן הרציג, בשיתוף עמותת ScienceAbroad
איתן הרציג הוא בעל תואר ד״ר לוירולוגיה מאוניברסיטת תל אביב, כיום מדען-חוקר באוניברסיטת קליפורניה בסן פרנסיסקו המשתמש בשיטות של תרפיה תאית וגנטית לטיפול בנגיף הHIV.
עמותת סיינס אברוד (ScienceAbroad) היא ארגון ללא כוונת רווח הפועל משנת 2006 לאיגוד מדעניות ומדענים ישראלים בחו"ל. מטרתה לחזק את הקשרים עם חוקרות וחוקרים ישראלים בעולם והשבת מוחות לישראל. קהילת המדעניות והמדענים של סיינס אברוד מונה יותר מ-3000 אנשי מחקר מהאוניברסיטאות הטובות בעולם. ארגון סיינס אברוד מעניק כלים, מפתח קשרים ופותח דלתות למדעניות ומדענים ישראלים המבקשים לשוב לישראל, על מנת שיביאו עימם את הידע, הניסיון והקשרים שצברו בחו"ל אל האקדמיה והתעשייה הישראלית, כמנוע צמיחה. בנוסף, חברי הארגון מעורבים בפרויקטים לשיפור תדמיתה של ישראל ומיתוגה של ישראל כמרכז מחקר ופיתוח, וכן להנגשת המדע לקהל הרחב בישראל ובעולם.
מקורות וקישורים לקריאה נוספת








