פרסומת
חומצה טרטרית נמצאת בטבע במגוון רב של צמחים, בעיקר בענבים. בחיי היום יום ניתן למצוא אותה בתחתית בקבוקי וחביות יין בתור גבישים צהבהבים-סגולים (כן, זה מה ששוקע בבקבוק היין הפתוח ששמתם במקרר!), כאשר היא שוקעת יחד עם יוני אשלגן. מימי קדם ועד היום תרכובת זו נקראת "קרם טרטר", ובשפה הכימית - אשלגן בי-טרטראט, ויש לה שימושים שונים בבישול וניקוי ביתי.
בעולם המדע החומצה הטרטרית שיחקה תפקיד חשוב בגילוי תכונת הכיראליות של חומרים. תכונה זו, עליה כתבנו בעבר [1], היא קיום שתי גרסאות של החומר, שהן תמונת מראה אחת של השנייה. חומרים רבים הקשורים לעולם החי הם כיראליים וישנו הבדל משמעותי בין תמונות המראה שלהם. דוגמה מפורסמת היא תרופת התאלידומיד, שמטרתה למנוע בחילות בוקר של נשים בעת היריון, אך תמונת המראה שלה גורמת לעיוותים קשים בילודים [2].
המדען הצרפתי לואי פסטר (Pasteur) גילה את הכיראליות בחומצה הטרטרית באמצעות התבוננות בגבישים של אשלגן בי-טרטראט ב-1848. גביש הוא מבנה מוצק תלת-מימדי שבו ארוזות מולקולות. ישנם סוגים רבים של גבישים המשתנים לפי החומר המרכיב אותם (מולקולות, אטומים, יונים…). הייחודיות של גביש היא שהוא מורכב ממבנה תא בסיסי, שחוזר על עצמו בכל נפח הגביש. חומרים רבים יכולים להתגבש תחת תנאים מתאימים. בחינה של גביש בעל פגמים מעטים יכולה לסייע להבין תכונות של החומר ברמה המולקולרית, כמו כיראליות.
כאשר פסטר בחן גבישים שונים של אשלגן בי-טרטראט תחת מיקרוסקופ הוא שם לב שחלק מהגבישים בעלי צורה מסוימת וחלקם בעלי צורה זהה אך הפוכה - תמונת מראה. לאחר ניסויים רבים ויצירה של אשלגן בי-טרטראט ממקורות שונים, הוא הגיע למסקנה שישנם שני סוגים של חומצה טרטרית, או במילים אחרות - שתי תמונות מראה של מולקולה כיראלית. מאוחר יותר, כאשר התעמק בניסוייו והשתמש בשיטות אופטיות, הוא הצליח למצוא סוג נוסף - חומצה טרטרית שאינה כיראלית.
ההבחנה של פסטר בין כמה מופעים של הגבישים של אותו החומר היא מרשימה במיוחד, מאחר שבאמצע המאה ה-19 הקונספט היחיד להבחנה בין חומרים היה שוני במבנה שלהם [3]. פסטר השכיל לומר שמדובר באותו החומר, למרות שהתקבלו גבישים בצורות שונות. ההבדל שהוא עמד עליו הוא המבנה המרחבי השונה, שמקורו בכיראליות המולקולה.
שלוש הוריאציות של החומצה הטרטרית נובעות משני המרכזים הכיראליים במולקולה. מהם מרכזים כיראליים? בהפשטה, אטומי פחמן יכולים להיות קשורים לשניים, שלושה או ארבעה אטומים נוספים. כל אחד מאטומים אלו יכול בתורו להיקשר למספר אטומים אחרים וליצור תתי-מבנה הקרויים "קבוצות כימיות". כאשר אטום פחמן קשור לארבעה אטומים, הקשרים הללו מסתדרים במרחב סביבו בצורת פירמידה משולשת משוכללת (טטראהדר) באופן כזה שאטום הפחמן נמצא במרכז, וכל אחד מארבעת האטומים הקשורים אליו נמצא בקודקודי הפירמידה [ראו איור]. אם ארבעת האטומים האלו יוצרים ארבע קבוצות כימיות שונות - אנו קוראים לפחמן "מרכז כיראלי". ניתן לסדר את הקבוצות במרחב מסביב לפחמנים כיראליים בשני אופנים שונים, אותם אנו מכנים בשמות R ו-S.

שני הסידורים האפשריים של ארבע קבוצות שונות (מסומנות באדום, ירוק, סגול וכחול) מסביב לאטום פחמן (בשחור).
אם נדמיין חץ המוביל מהקבוצה הסגולה לקבוצה האדומה (ובהתאמה: מהקבוצה הירוקה לקבוצה הסגולה, או מהקבוצה האדומה לקבוצה הירוקה) - כיוון החץ יכול להיות עם כיוון השעון (מסומן ב-R) או נגד כיוון השעון (מסומן ב-S). לא משנה כמה נסובב את המולקולה במרחב התלת-מימדי, צורת הסידור R לא תהפוך ל-S ולהיפך. הדרך היחידה לעבור בין הצורות הוא "היפוך" המולקולה דרך מישור (הקו המקווקו), פעולה שכמובן אינה אפשרית במציאות.
כאמור, בחומצה הטרטרית ישנם שני מרכזים כיראליים, וכל אחד מהם יכול להיות מסוג R או S. כלומר, הסידורים האפשריים הם:
R-R, R-S, S-R, S-S
במקרה של החומצה הטרטרית הסידורים R-S ו-S-R זהים, ולכן בסך הכל ישנן שלוש אפשרויות:
- שני המרכזים בצורת R.
- שני המרכזים בצורת S.
- אחד המרכזים בצורת R והאחר בצורת S.
אלו בדיוק שלושת הסוגים של החומצה הטרטרית שפסטר מצא בניסוייו!

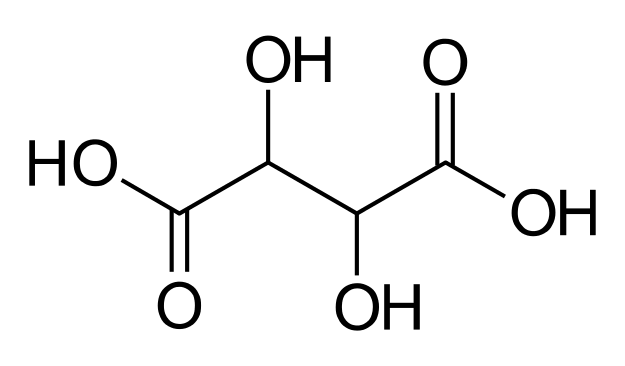
חומצה טרטרית. כל אחד משני הפחמנים הכיראליים יכול להיות באחד משני סידורים: R או S. בשל מבנה המולקולה אין הבדל בין שני המצבים בהם לפחמנים הללו סידורים הפוכים (כלומר R,S זהה ל-S,R), ולכן מתקבלות בסופו של דבר שלוש קונפיגורציות אפשריות לכלל המולקולה: R,R S,S ו-R,S. רק המולקולות בעלות הקונפיגורציה S,S או R,R נחשבות לאננטיומרים.
כיום חומצה טרטרית משמשת כתוסף מזון וכמשפרת טעם בתרופות שונות. בתחילת שנות ה-2000 החלו להשתמש בה כמולקולת מודל עבור שינוי פני שטח לזרזים, זאת במטרה להאיץ תגובות בהן ישנה חשיבות לכיראליות התוצרים [4]. ניתן לראות אותה כפסקה נוספת בסיפור של הכיראליות בכימיה. עבודתו של פסטר הציתה את הדמיון של המדענים שבאו אחריו ועליה מתבסס מדע התרופות כפי שאנו מכירים אותו היום.








